Introduction
La couleur du grain est le résultat d’une combinaison de la coloration de trois tissus différents :
-la chaire du grain (endosperme ou albumen), dont les parts d’amidon vitreux et d’amidon farineux sont variables d’un grain à l’autre, peut prendre 4 teintes de jaune différentes allant du jaune vif au blanc. Certaines variations génétiques vont aussi jouer sur les teintes orange du grain.
-La couche à aleurone (aleuron) peut prendre trois teintes différentes : le violet, le rouge et l’incolore (transparent).
-Le péricarpe, la couche externe du grain peut prendre deux couleurs différentes : le rouge et l’incolore (transparent).
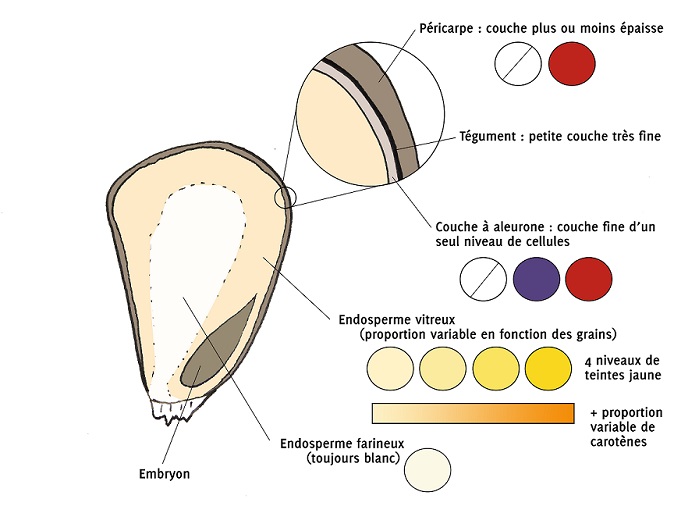
Figure 1: Représentation des différents tissus qui composent la paroi du grain de maïs et la grande majorité des couleurs qu’ils peuvent prendre - source: Robin NOEL
Origine des tissus du grain
Pour comprendre comment la couleur est construite et se transmet génétiquement, il est nécessaire de connaître l’origine physiologique et génétique des quatre tissus végétaux qui composent le grain de maïs : le péricarpe, la couche à aleurone, l’albumen et l’embryon. La génétique transmise à la plante fille correspond uniquement à la génétique présente dans l’embryon.
La figure 2.1 présente le développement de ces tissus et l’information génétique contenue dans chacun d’eux avec un modèle à deux paires de chromosomes.
L’information génétique du maïs est portée par 10 paires de chromosomes, chaque paire est composée d’un chromosome d’origine maternelle et d’un chromosome d’origine paternelle. Chaque chromosome est constitué des deux chromatides (deux « bâtons ») strictement identiques reliés à peu près en leur milieu (d’où la forme de X).
Prenons un exemple simple avec 1 paire de chromosome.
Voie male
Lors de la formation du grain de pollen, le processus de la méiose divise 1 cellule avec 1 paire de chromosome (dit diploïde) en deux cellules avec 1 chromosome (dit haploïde) puis en 4 cellules avec 1 chromatide. Chaque cellule devient un grain de pollen.
Au sein de ce grain de pollen, la cellule à une chromatide duplique la chromatide pour donner une cellule à un chromosome puis se divise pour donner deux cellules à un chromatide. Ces deux cellules sont deux zygotes mâles (spermatozoïdes) qui viendront féconder le grain. L’information génétique portée dans ces deux zygotes est identique.
Voie femelle
L’organe femelle est composé notamment du sac embryonnaire (qui donnera le futur grain) et d’un très long pistil que l’on appelle une soie. Une seule cellule est à l’origine du sac embryonnaire (appelée archéospore), son développement commence aussi par une méiose qui transforme une cellule avec une paire de chromosomes en 4 cellules avec un chromatide. Trois des quatre cellules avortent. La cellule qui reste fertile subit 3 mitoses successives (division à l’identique des cellules) et donne alors 8 cellules à une chromatide, ces 8 cellules portent la même information génétique. Parmi ces 8 cellules, 3 vont constituer le futur grain : l’oosphère (zygote femelle) et les 2 noyaux polaires.
Double fecondation
Lorsque le grain de pollen se pose sur une soie, il se fixe et déploient un long tube appelé « tube pollinique » qui remonte toute la soie jusqu’au sac embryonnaire. Ce tube pollinique transporte les deux zygotes mâles.
Une fois le sac embryonnaire atteint, un des zygotes va pénétrer l’oosphère et leurs noyaux vont se fusionner, cette nouvelle cellule est la cellule embryonnaire qui donnera le germe du grain et qui porte toute l’information génétique de la futur plante. Le noyau de la cellule embryonnaire contient une paire de chromosome : un chromosome issu du zygote mâle et un chromosome issu du zygote femelle. C’est la première fécondation.
La seconde fécondation consiste en la fusion du deuxième zygote avec les deux noyaux polaires. Cette cellule est dite triploïde car son noyau contient trois chromosomes : deux venant des deux noyaux polaires et un venant du second zygote mâle. Cette cellule en se multipliant va donner l’albumen et la couche à aleurone.
Pericarpe
Le péricarpe est un tissu uniquement maternel qui entoure le grain. Ainsi, le péricarpe de tous les grains, de tous les épis d’une plante possède la même génétique.
![Processus de formations des gamètes mâles et femelles, double fécondation et développement du grain.
Sources: slideplayer.fr, [@twellPollenDevelopmentGenetic2006], [@sabelliDevelopmentEndospermGrasses2009].](../../../../../img/kernel_color/fecondation_mais.jpg)
Figure 2: Processus de formations des gamètes mâles et femelles, double fécondation et développement du grain. Sources: slideplayer.fr, [1], [2].
Couleur de l’albumen
Jaune et blanc
La couleur de l’albumen peut prendre différentes teintes de jaune ou d’orange. Toutes ces teintes dépendent de la nature et des proportions des pigments de la famille des caroténoïdes. En cas d’absence de pigments, l’albumen du grain est blanc[3]. Un des gènes structurel à la base de la synthèse des caroténoïdes est le gène Y1 (ou « White1 »).
| Nom.du.gène | Rôle.métabolique | Symbole | Phénotype |
|---|---|---|---|
| White 1 | Structurel | Y1 | Albumen jaune |
| y1 | Albumen blanc |
Ce gène possède deux allèles : Y1 et y1 et rappelons que l’albumen est un tissu triploïde (il contient donc 3 chromosomes). La contribution maternelle est soit Y1Y1, soit y1y1 (car les deux noyaux polaires à l’origine de la cellule souche de l’albumen ont strictement la même génétique). Et la contribution paternelle est soit Y1, soit y1.
Il existe 4 combinaisons possibles :
Y1Y1Y1 : albumen jaune vif
Y1Y1y1 : albumen jaune
Y1y1y1 : albumen jaune pâle
y1y1y1 : albumen blanc
Cette construction génétique simple permet d’illustrer différents scénarii d’héritabilité de la couleur.
Cas1 : Imaginons une plante maternelle hétérozygote de génétique Y1y1 (ex : cas possible dans une variété jaune avec des variations de teintes de jaune et de blanc) qui subit une pollinisation forcée avec une plante paternelle de génétique y1y1 (variété blanche).
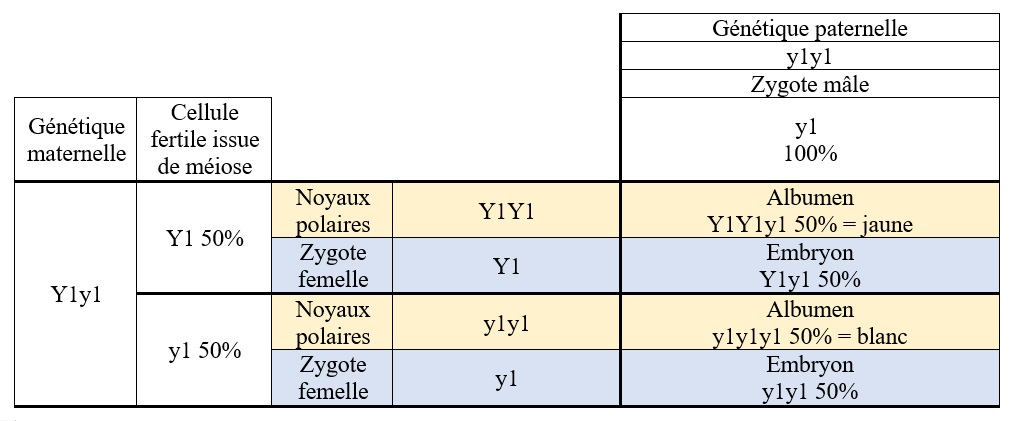
Figure 3: Croisement y1y1 sur Y1y1
L’épi issu de cette fécondation aura une proportion identique de grains blancs et de grains jaunes répartis aléatoirement.
Cas2 : Imaginons à présent la situation inverse : une plante maternelle homozygote de génétique y1y1 (variété blanche) qui subit une pollinisation forcée par une plante paternelle hétérozygote de génétique Y1y1 (ex : cas possible dans une variété jaune avec des variations de teintes de jaune et de blanc).

Figure 4: Croisement Y1y1 sur y1y1
L’épi issu de cette fécondation aura une proportion identique de grains blancs et de grains jaunes pâles répartis aléatoirement.
Dans tous les cas, on peut affirmer qu’un grain blanc semé de manière isolée donnera toujours une plante avec un épi blanc. Par contre, un grain jaune semé de manière isolé donnera soit un épi jaune, soit un épi jaune et blanc.
Calculer les proportions de l’allèle y1 et Y1 dans une population à partir du nombre de grains blancs [4].
Lorsqu’un grain est blanc, la génétique qu’il porte dans son embryon est y1y1. Cette combinaison est le fruit d’un tirage aléatoire parmi l’ensemble des gamètes mâles dans la population et celui d’un autre tirage dans l’ensemble des gamètes femelles dans la population. Par exemple si les proportions de Y1 et de y1 dans la population sont égales (50%) ; pour obtenir le tirage y1y1, il faut tirer une première fois l’allèle y1 (une chance sur deux) et une deuxième fois l’allèle y1 (une chance sur deux).
On note donc :
P(y1y1) : la proportion de génotype y1y1 dans la population (= grains blancs) P(y1) : la proportion d’allèle y1 dans la population
Où :
P(y1y1) = P(y1) x P (y1) P(y1y1) = P (y1)2
Et inversement :
P(y1) = √(P(y1y1))
Donc si on a 10% de grains blanc dans une population:
P(y1)= √(P(y1y1) )= √0,1=0,32=32% La proportion de l’allèle y1 dans la population est de 32% et celle de l’allèle Y1 de 100 - 32 = 68%
Vers le orange

Figure 5: Différentes teintes de grain
Il existe plusieurs types de pigments dans la famille des caroténoïdes : le gène Y1 que nous avons étudié précédemment est nécessaire à la construction d’une molécule, appelée phytoène, à la base de tous les types de caroténoïdes.
D’autres gènes (principalement zds1) vont ensuite intervenir pour transformer cette molécule en lycopène : un pigment orange que l’on trouve par exemple chez la tomate.
Ensuite, en fonction de l’expression du gène lcyE, le lycopène va soit se transformer en α-carotène, soit en β-carotène. Chacun de ces caroténoïdes peut encore évoluer sous l’action d’autres gènes pour donner d’autres types de pigments (lutéine, zéaxanthine, β-cryptoxanthine, violaxanthine)[5].
Il existe un lien entre l’appréciation visuelle de la couleur orange du grain et la concentration de caroténoïdes d’intérêts (car précurseurs de la vitamine A : α-carotènen, β-carotène et β-cryptoxanthine) mais cette corrélation est très faible [6].
Couleurs et proteines
Les variétés de maïs blancs ont la réputation d’être plus riches en protéines que les variétés au grain jaune et les données acquissent par la Maison de la Semence Paysanne de Dordogne sur plus d’une centaine de variétés montrent que, en moyenne, les variétés blanche sont plus riches en protéines que les variétés jaunes (mais ce n’est pas systématique). Cette constatation n’est cependant pas explicable d’un point de vue physiologique. La raison de cette corrélation se trouve peut-être dans les histoires génétiques et sociologiques de chaque variété (hypothèse: les variétés blanches et jaunes occupaient des rôles différents dans les systèmes agricoles, donc caractéristiques différentes, et la couleur permettait simplement de les distinguer les unes des autres).
Couleur de l’aleurone
Les traits phénotypiques sont souvent codés par plus d’un gène, et il peut exister de nombreuses versions pour chacun des gènes. L’épistasie désigne l’interaction existante entre plusieurs gènes, elle s’applique notamment lorsqu’un caractère phénotypique est la résultante d’une chaine métabolique et que plusieurs gènes sont impliqués dans la chaine métabolique.
La couleur de la couche à aleurone (aleuron) du grain de maïs est un exemple d’épistasie. La couche à aleurone est un tissu fin constitué d’une seule couche cellulaire et situé entre le péricarpe et l’albumen (endosperm) du grain de maïs [7]. Il s’agit d’un tissu triploïde (3 chromosomes par type de chromosome) issu de la fusion des deux noyaux polaires du sac embryonnaire et d’un des deux zygotes mâle qui ont fécondé le grain.
La couche à aleurone peut prendre trois teintes différentes : le rouge, le violet ou incolore. Dans ce dernier cas, le grain sera alors de la couleur de l’albumen : blanc ou jaune. Trois gènes sont impliqués dans l’expression de la couleur[3]:
| Nom.du.gène | Rôle.métabolique | Symbole | Phénotype |
|---|---|---|---|
| Red Aleurone 1 | Structurel | Pr1 | Aleurone violet |
| pr1 | Aleurone rouge | ||
| Colored 1 | Régulation | R1 | Aleurone coloré |
| r1 | Aleurone incolore | ||
| Colored Aleurone 1 | Régulation | C1 | Aleurone coloré |
| C1-I | Ameurone incolore | ||
| c1 | Aleurone incolore |
Le gène Pr1 code pour une protéine (flavonoid 3’-hydroxylase) impliquée dans la synthèse de pigments violets dans la chaine métabolique des anthocyanes. Les gènes R1 et C1 sont des gènes de régulation : ils codent pour des activateurs ou inhibiteurs de transcription et sont susceptibles d’interrompre ou non la synthèse des anthocyanes.
Il existe 144 combinaisons possibles avec ces trois gènes : la couche à aleurone est incolore pour 108 combinaisons, rouge pour 9 et violette pour 27. Cet exemple met en œuvre deux phénomènes d’épistasie : une épistasie dominante avec le gène Colored Aleurone 1 car la seule présence de l’allèle C1-1 dans le génome suffit à inhiber la synthèse d’anthocyane. Et deux épistasies récessives avec le gène Colored1 car seul l’homozygote r1r1r1 induit l’inhibition de la synthèse d’anthocyanes et avec le gène Colored Aleurone 1 car l’homozygote c1c1c1 induit aussi l’inhibition de la synthèse d’anthocyanes.
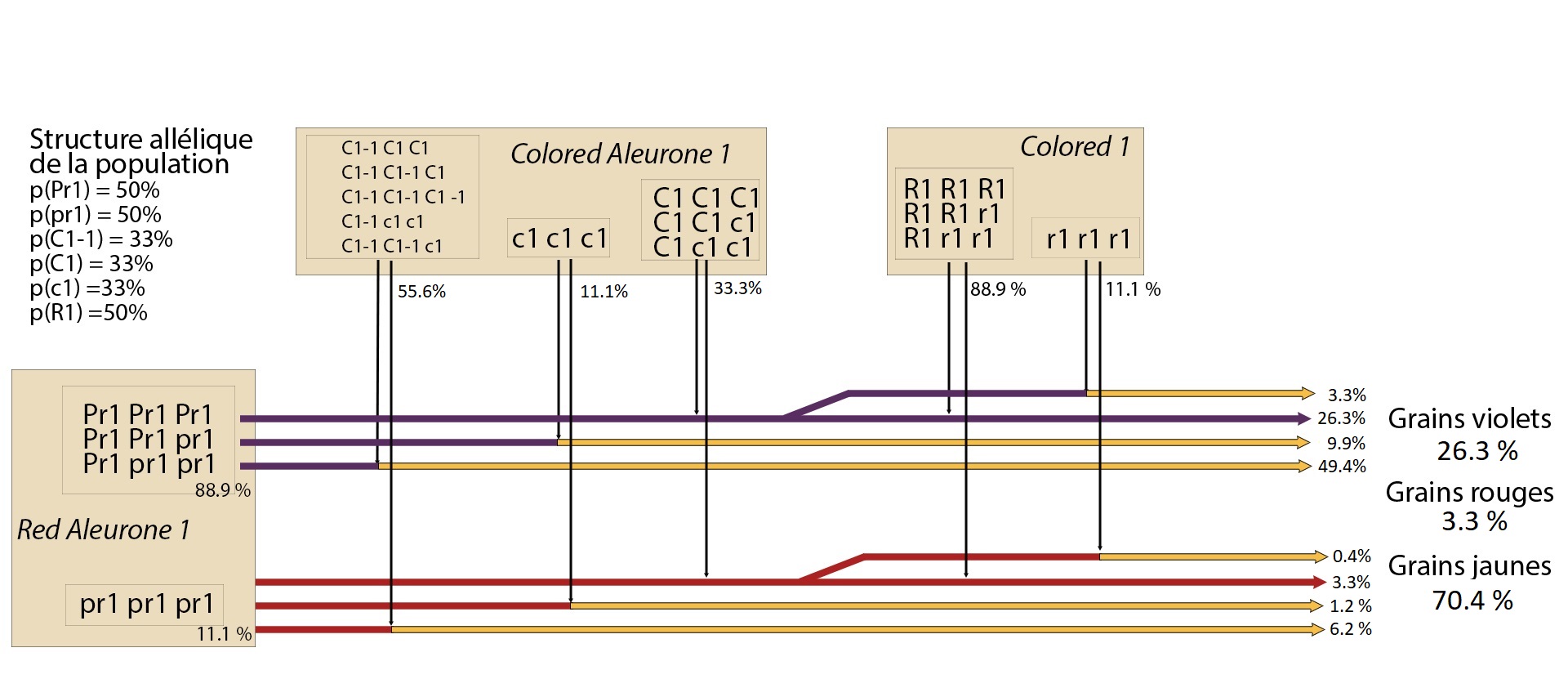
Figure 6: Illustration du phénomène d’épistasie sur la construction de la couleur de la couche à aleurone. Exemple d’une population avec une structure allélique équilibrée.
L’étude génétique des plantes cultivées montre de manière récurrente la présence de phénomènes d’épistasie et d’interactions particulières entre gènes impliqués dans l’expression de la plupart des caractères qualitatifs (couleur du grain) mais surtout quantitatifs (rendement, taille de la plante) [8][9].
Couleur du pericarpe, rafle et soies
Le péricarpe est un tissu maternel diploïde (2n), ainsi, les péricarpes de tous les grains d’un épi sont de la même couleur (sauf cas très particuliers).
Le gène Pr1 (red aleurone 1) qui intervient dans la biosynthèse du pigment responsable de la couleur de l’aleurone (flavonoid 3’-hydroxylase) joue aussi un rôle dans l’accumulation d’un autre pigment de la famille des anthocyanes (3-deoxyflavonoids) et de phlobaphenes (autre famille de pigments) dans le péricarpe du grain, dans les glumes de la rafle et dans les soies. La biosynthèse du 3-deoxyflavonoids est régulée par le gène P1 (Pericarp color1) mais est indépendant des gènes de régulation C1 et R1[10].
Le rôle de régulation du gène P1 dépasse la régulation des pigments de certains tissus et semble moduler l’expression de plus de 1500 gènes. Il a par exemple été mis en évidence que le gène P1 joue un rôle majeur dans la synthèse d’un insecticide naturel (le C-glycosyl flavones)[11]. Au-delà de cet exemple isolé, il est possible d’affirmer qu’il existe un lien qui lie la couleur du grain, de la rafle et des soies avec d’autres caractères phénotypiques d’intérêt agronomique ou non. La nature de ces liens est complexe et méconnue et semble difficile à mobiliser dans le cadre de la sélection paysanne même si certains agriculteurs témoignent parfois “les maïs aux épis rouges semblent plus sains”, est-ce un hasard?
Il existe d’innombrables versions (allèles) au gène P1 qui sont la plupart du temps regroupées sous quatre groupes [12]:
-P1-ww : péricarpe blanc et rafle blanche
-P1-rw : péricarpe rouge et rafle blanche (semble plus rare)
-P1-wr : péricarpe blanc et rafle rouge
-P1-rr : péricarpe rouge et rafle rouge
Comme il ne s’agit pas d’allèles au sens strict, il n’est pas possible d’établir un régime de dominance entre ces quatre variantes. De plus il existe de nombreux gènes de régulation au gène P1 (qui est lui aussi un gène de régulation) comme les gènes C2, Chi1, A1 ou Tub1 et donne lieu à des phénomènes complexes d’épistasie [13].
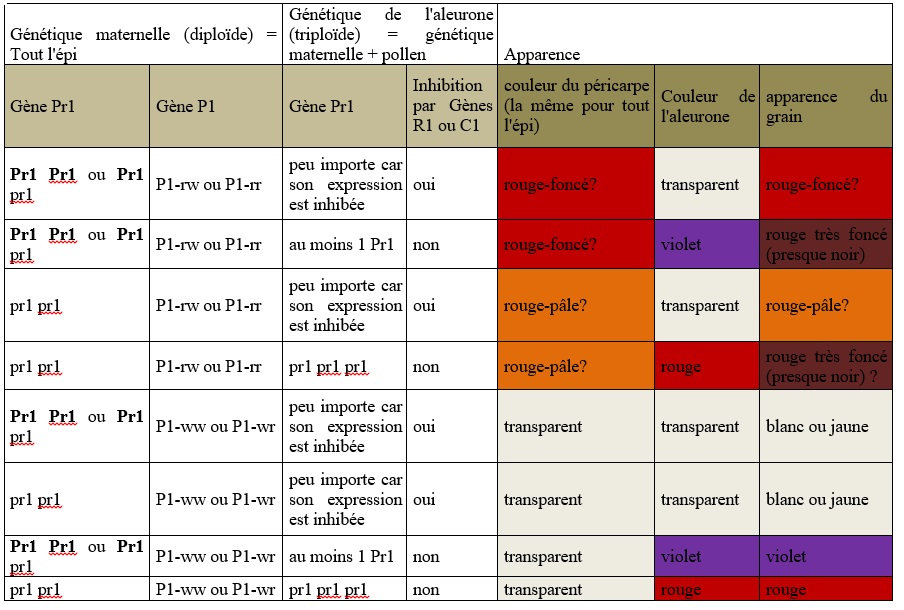
Figure 7: Tableau récapitulatif des combinaisons génétiques expliquant la couleur du grain en combinant la couleur du péricarpe et la couleur de l’aleurone.

Figure 8: Epis de la variété Bardot de Bresse
Exemple sur une population de Bardot de Bresse*, les épis à dominance rouge sont du groupe d’allèles P1-rw ou P1-rr sur le gène P1 (donc péricarpe rouge) et les grains noirs parmi ces épis rouges sont le résultat de la superposition d’une aleurone colorée (ici probablement violet) (dont l’information génétique est le résultat d’une combinaison particulière entre la génétique maternelle et la génétique d’un grain de pollen) et du péricarpe rouge. Le phénomène est le même pour les épis à dominance blanche ou jaune mais ils sont des groupes P1-ww ou P1-wr sur le gène P1 ; comme le péricarpe est transparent, les grains à l’aleurone violet apparaissent violets. On note de plus l’absence de grain rouge isolé (aleurone rouge), on peut donc déduire que l’allèle recessif pr1 est probablement absent de cette population.
*Il s’agit ici d’une version “polluée” de Bardot de Bresse, le “vrai” Bardot ne présente pas de grains jaunes.
Et encore plein de choses a decouvrir


Figure 9: Le côté moucheté est dû à l’action de petits filous de la génétiques qu’on appelle transposons, il ont été découverts par la chercheuse Barbara McClintock qui semblait férue de jolis maïs

Figure 10: Nous affirmions dans cet article que tous les péricarpes de tous les grains de tous les épis d’une plante sont de la même couleur… sauf exception! Pas de certitude ici sur le phénomène observé, nous supposons qu’il s’agit d’un crossing-over (des chromosomes qui s’échangent des morceaux pendant que les cellules ce multiplient) qui intervient dans les mitoses qui ont lieu au tout début de la formation de l’épi

Figure 11: Un mystère… Il y a ici une anomalie dans la synthèse des pigments (anthocyanes ou phlobaphènes), cela est probablement le fait de transposons

Figure 12: On a étudié le blanc, le jaune, le orange, le violet, le rouge mais pour ce qui est du vert… pas d’hypothèse en vue pour le moment…

Figure 13: Un magnifique alien venu du Pérou!
References
[1] D. Twell, S.-A. Oh, and D. Honys, “Pollen Development, a Genetic and Transcriptomic View,” in The Pollen Tube, vol. 3, R. Malhó, Ed. Berlin/Heidelberg: Springer-Verlag, 2006, pp. 15–45.
[2] P. A. Sabelli and B. A. Larkins, “The Development of Endosperm in Grasses,” PLANT PHYSIOLOGY, vol. 149, no. 1, pp. 14–26, Jan. 2009.
[3] R. H.Ford, “Inheritance of Kernel Color in Corn: Explanations & Investigations,” The American Biology Teacher, vol. 62, no. 3, pp. 181–188, 2000.
[4] D. Falconner, Introduction to quantitative genetics. The Ronald Press Company New York, 1960.
[5] K. Chandler et al., “Genetic Analysis of Visually Scored Orange Kernel Color in Maize,” Crop Science, vol. 53, no. 1, p. 189, 2013.
[6] C. E. Harjes et al., “Natural Genetic Variation in Lycopene Epsilon Cyclase Tapped for Maize Biofortification,” Science, vol. 319, no. 5861, pp. 330–333, Jan. 2008.
[7] M. Freeling and V. Walbot, The maize handbook. Springer-Verlag, 1994.
[8] A. R. Hallauer, M. J. Carena, and J. de Miranda Filho, Quantitative genetics in maize breeding, vol. 6. Springer Science & Business Media, 2010.
[9] M. Shahrokhi, S. Khavari Khorasani, and A. Ebrahimi, “Study of genetic components in various maize (Zea mays L.) traits, using generation mean analysis method,” International journal of Agronomy and Plant Production, vol. 4, no. 3, pp. 405–412, 2013.
[10] M. Sharma, C. Chai, K. Morohashi, E. Grotewold, M. E Snook, and S. Chopra, “Expression of floavonoid 3’hydroxylase is controlled by P1, the regulator of 3-deoxulflavonoid biosynthesis in maize,” Plant Biology, vol. 12, no. 196, 2012.
[11] K. Morohashi et al., “Genome-wide Regulatory framework Identifies Maize Pericarp Color1 Controlled Genes.Pdf,” The Plant Cell, vol. 24, pp. 2745–2764, 2012.
[12] S. Cocciolone, S. Chopra, S. A. Flint-Garcia, M. McMullen, and T. Peterson, “Tissue-specific pattern of a maize Myb transcription factor are epigenetically refulated,” The Plant Journal, vol. 27, no. 5, pp. 467–478, 2001.
[13] S. Chopra, P. Athma, and T. Peterson, “Alleles of the Maize P Gene with Distinct Tissue Specificities Encode Myb-Homologous Proteins with C-Terminal Remplacement,” The Plant Cell, vol. 8, pp. 1149–1158, 1995.